Capítulo 1. EL MODELO ATÓMICO
Las primeras ideas sobre los átomos hacían pensar en unas unidades muy pequeñas e indivisibles, de forma que no podían contener nada en su interior, pero según se fueron desarrollando las técnicas de investigación, se descubrió que están formados por partículas aun más diminutas. Las partículas subatómicas son de tres tipos:
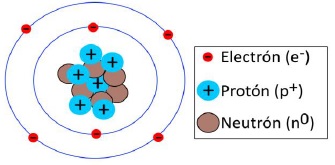
- Electrones: Se encuentran en la periferia o corteza del átomo y tienen carga eléctrica negativa; su masa es la más pequeña de las tres.
- Protones: Son mucho mayores que los electrones (unas 2000 veces) y se encuentran en el interior del átomo; tienen carga positiva.
- Neutrones: También se encuentran en el interior como los protones, siendo su masa similar a la de ellos pero sin actividad eléctrica, es decir, son neutros.
En 1906, Rutherford (físico inglés) consiguió atravesar finas láminas de oro con partículas α (formadas por 2 protones y 2 neutrones) lo que hizo pensar que el átomo estaba prácticamente hueco, de forma que la distancia entre el núcleo y la corteza es sumamente grande en comparación con las dimensiones de las partículas subatómicas.
Los átomos se caracterizan por poseer protones y neutrones en el núcleo y electrones en la corteza. Por lo tanto, el átomo más sencillo que existe debe tener un protón en el núcleo y un electrón en la corteza. Se trata del átomo de hidrógeno (H). Si existiera otro protón en el núcleo y otro electrón en la corteza, se trataría de otro átomo diferente al anterior y el segundo en cuanto a sencillez. Es el átomo de helio (He).
Los neutrones no influyen en la diferenciación de los átomos. Así, por ejemplo, los átomos que forman el hidrógeno pueden tener uno, dos o ningún neutrón, pero siguen formando el mismo gas hidrógeno. Lo mismo sucede en el resto de los átomos. Puesto que los átomos son eléctricamente neutros, el número de protones debe ser igual al de electrones y así, al sumar las cargas eléctricas con su correspondiente signo, el resultado es cero. Al número de protones que tiene cada átomo se le llama número atómico.
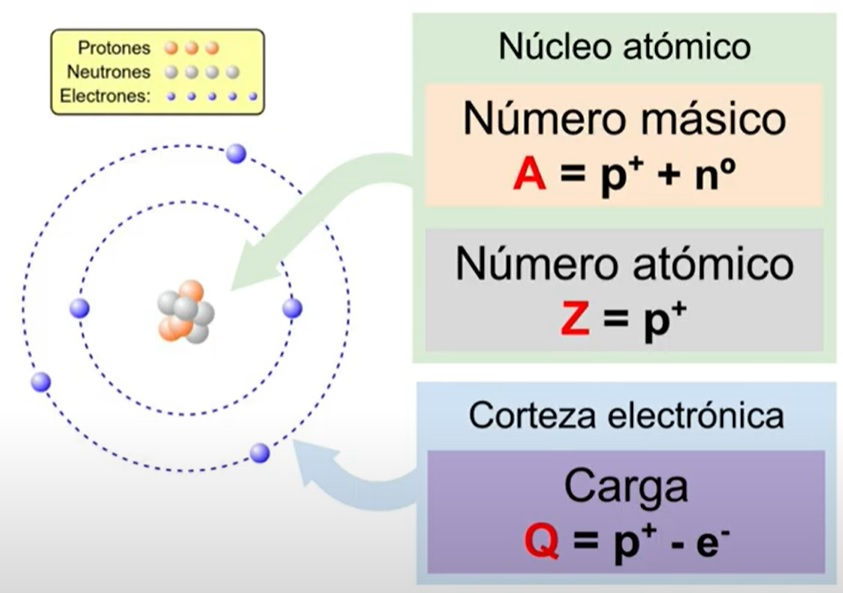
Las propiedades químicas de las sustancias dependen de la corteza del átomo, que es donde se encuentran los electrones. Aunque las propiedades químicas sean las mismas, la masa de los átomos de un elemento dependen de la cantidad de neutrones y protones que contengan. Aquellos átomos que tienen el mismo número de protones pero distinto número de neutrones en el núcleo se llaman isótopos. Al resultado de la suma del número de protones y neutrones de un átomo se le llama número másico.

Capítulo 2. EL SISTEMA PERIÓDICO
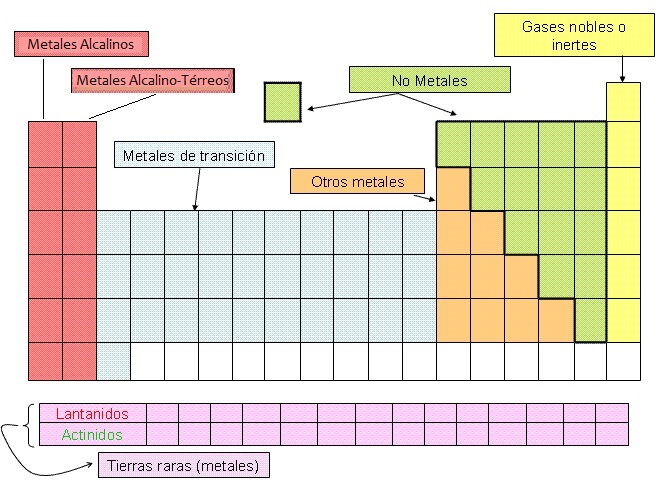
En la ilustración aparecen ordenados los átomos conocidos con sus correspondientes símbolos. Es lo que se llama sistema periódico.

No todos los átomos que aparecen en la tabla existen realmente en la naturaleza, algunos han sido creados artificialmente en el laboratorio y no se encuentran en el entorno natural. Tanto unos como otros se encuentran ordenados por su número atómico, apareciendo el símbolo de cada uno de ellos y el nombre de los mismos.
En el sistema periódico los elementos distribuidos en filas y columnas. A cada una de las filas la llamamos periodo y a cada columna, grupo. Por lo tanto, el sistema periódico está formado por 7 periodos y 18 grupos.
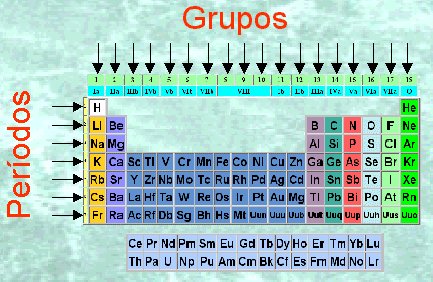
Todos aquellos elementos que pertenecen al mismo grupo se caracterizan por tener propiedades similares (carácter metálico, capacidad para combinarse con otros elementos,…). Por ello, algunos grupos reciben nombres particulares; así, el primero de ellos es el grupo de los elementos alcalinos, el siguiente el de los alcalino-térreos,…
La clasificación más general de los elementos del sistema periódico los divide en dos grandes grupos. Así, llamaremos metales a todos aquellos elementos que sean buenos conductores del calor y la electricidad, que tengan brillo metálico y que reaccionen con sustancias ácidas. Llamaremos no metales a los que carezcan de esas propiedades.
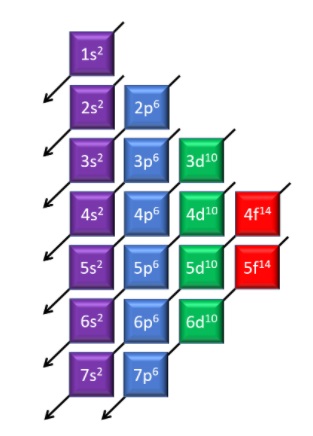
Los electrones están situados en el átomo formando distintas capas. Cada una de ellas consta de una serie de niveles que se llaman orbitales, dentro de las cuales se encuentran los electrones que posee cada átomo. La primera capa, la más interna, consta de un solo orbital llamado 1s en el que caben 2 electrones. La segunda capa dispone de dos tipos de orbitales, el 2s y el 2p en los que caben 2 y 6 electrones respectivamente. En la tercera capa hay tres tipos de orbitales: 3s (2 electrones), 3p (6 electrones) y 3d (10 electrones). En la 4 capa: 4s, 4p, 4d y 4f (con 14 electrones)…
Si sumamos los electrones que pueden ocupar cada uno de los orbitales tendremos:
- En la primera capa pueden existir dos electrones, correspondientes al orbital 1s
- En la segunda, 8; 2 en el orbital 2s y 6 en los 2p
- En la tercera, 18; 2 en el 3s, 6 en los 3p y 10 en los 3d
- En la cuarta, 32; 2 en el 4s, 6 en los 4p, 10 en los 4d y 14 en los 4f…
y de esta forma podríamos seguir calculando la capacidad de cada una de las capas, teniendo en cuenta que el número máximo de electrones en cada una de ellas responde a la fórmula: número de electrones = 2·n2, siendo n el número de la capa.
El orden de llenado de electrones no siempre coincide con el de las capas. En la ilustración puedes ver que antes de llenarse el orbital 3d comienza a llenarse el 4s y hasta que no está completo no se llena el d de la capa anterior. Lo mismo sucede con otros casos, por lo que a la hora de establecer la estructura de un elemento deberemos seguir ese orden determinado.
La radioactividad es una radiación emitida por algunos de los elementos del sistema periódico. Sus efectos en el ser humano pueden llegar a ser muy perniciosos cuando la intensidad sobrepasa ciertos límites. En la naturaleza existen algunos elementos radioactivos, cuyos núcleos atómicos no son estables y emiten radiación, como el Uranio (U), el Polonio (Po) o el Torio (Th). La radiación puede ser de varios tipos:
- Alfa (α), núcleos del átomo de Helio (He)
- Beta (β), electrones
- Gamma (ϒ), radiación fuertemente energética

Capítulo 3. LA MASA ATÓMICA
La masa atómica es la masa de un átomo comparada con la masa de un átomo de hidrógeno (aunque en la actualidad se toma como referencia la doceava parte de la masa de un átomo de Carbono). Eso no quiere decir que si la masa del nitrógeno es 14, un átomo de nitrógeno tenga de masa 14 gramos, ya que como acabamos de ver, se trata de una magnitud relativa.
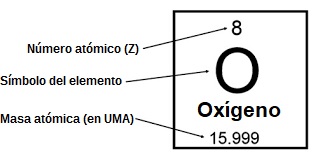
Sin embargo, a la hora de trabajar en el laboratorio o en la industria se usan unidades reales de masa. Para ello los científicos usan una unidad de masa llamada mol, que corresponde con una cantidad de gramos igual a la masa atómica de cada elemento. Así, un mol de sodio son 23 gr de sodio (Na), ya que su masa atómica es de 23. De esta forma, cuando a la masa atómica le añadimos la palabra “gramos” estamos trabajando con un mol de ese elemento.

Capítulo 4. LAS MOLÉCULAS
La materia no está formada por átomos aislados de Nitrógeno (Ni), de hidrógeno (HA), de fósforo (P) o de cualquier otro tipo, sino por grupos de ellos, iguales o diferentes, que llamamos moléculas. Así, el agua que bebemos está formada por infinidad de moléculas, cada una de las cuales tiene dos átomos de hidrógeno y uno de oxígeno. El cloro presente en el agua también está formado por gran cantidad de moléculas, en este caso cada una con dos átomos de cloro (Cl).
Eso quiere decir que hay sustancias formadas por un solo tipo de átomos (como el cloro o el fósforo) y hay otras en las que participan átomos distintos (como en el agua o el amoniaco). En el primer caso decimos que las sustancias son elementos químicos y en el segundo caso se trata de compuestos químicos. Por eso, el fósforo es un elemento mientras que el agua es un compuesto.

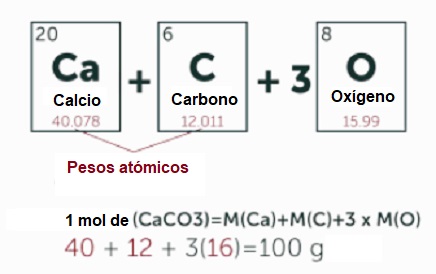
Para representar las sustancias, en química se utiliza la fórmula química correspondiente a cada una. Así el agua se representa por H2O y el carbonato de calcio, que forma los huesos o los dientes, por CaCO3. Las fórmulas no pretenden solamente dar un nombre a la sustancia sino que intentan darnos una información sobre la molécula a partir de la cual está formada.
Si nos fijamos en la fórmula del compuesto de los huesos vemos que está formada por las letras Ca, C y O que corresponden con los símbolos de los elementos químicos del sistema periódico; calcio, carbono y oxígeno. El número que aparece bajo el símbolo del oxígeno indica que son 3 los átomos de ese elemento los que forman la molécula. Si no hay ningún número, como ocurre bajo el calcio y bajo el carbono, indica que sólo hay un átomo de esos elementos en la molécula.

Si para calcular la masa de un mol de átomos el procedimiento era buscar en el sistema periódico la masa atómica del correspondiente átomo y expresar esa cantidad en gramos, para calcular la masa de un mol de una molécula calcularemos la masa molecular y la expresaremos en gramos. Por ejemplo, la masa de un mol de carbonato cálcico (CaCO3) será:
- Buscamos en el sistema periódico la masa atómica de cada uno de los átomos componentes de la molécula (la del Calcio es 40, la del carbono es 12 y la del oxígeno, 16)
- Las multiplicamos por sus subíndices respectivos: (40×1, 12×1 y 16×3)
- Sumamos los resultados obtenidos (100)
- Expresamos el resultado en gramos: Masa de un mol de Carbonato cálcico = 100 gramos