Capítulo 1. EL ENLACE QUÍMICO
Dentro de las configuraciones electrónicas de los átomos hay algunas que son muy estables, las que tienen completa la última de sus capas. Los elementos que tienen estas estructuras son muy estables y es difícil que experimenten transformaciones químicas. Por eso forman el grupo llamado gases nobles. El resto de los elementos tienen cierta tendencia a aproximarse a esa estructura por lo que son capaces de perder, ganar o compartir electrones.
Si pierden uno o más electrones, el número de protones del núcleo sería mayor por lo que tendría carga positiva. Es lo que llamamos un ion positivo o catión. En caso de ganar electrones, se formaría un ion negativo o anión.

Entre los elementos químicos se pueden dar varios tipos de enlaces químicos:
- Enlace iónico: Cuando un catión y un anión se aproximan entre sí, aparecen entre ellos fuerzas de tipo eléctrico que les mantienen unidos. La unión entre los iones no se realiza solamente a partir de dos de ellos. Intervienen muchos más, formando una estructura geométrica que se repite en las tres direcciones del espacio.
- Enlace covalente: Compartición de uno o varios electrones entre dos átomos que de esta manera quedan unidos.
- Enlace metálico: Está formado por estructuras de átomos sumamente compactas que dejan electrones libres que pueden moverse por todo el material.

Capítulo 2. ESTADOS DE LA MATERIA
Ya conoces los tres estados de la materia (trabajados en el Módulo Materia y Energía I del curso 1.2): sólido, líquido y gaseoso.
El estado sólido.
La propiedad más característica de los sólidos es que tienen forma definida que no varía al cambiarlos de un recipiente a otro. Otras propiedades específicas de los sólidos:
- Elasticidad: Cuando estiramos o comprimimos un muelle de acero, éste retorna a su estado anterior en cuanto abandonamos la fuerza que ejercíamos sobre él. Esta propiedad de recuperación se llama elasticidad y la poseen algunos materiales como la goma, el caucho o el muelle de acero.

- Brillo: Cuando sobre una superficie incide un rayo de luz, éste se puede reflejar de diferentes formas dando lugar a diferentes tipos de brillos: metálico, vítreo, nacarado… Otros cuerpos carecen de brillo como el corcho o el cartón.

- Dureza: Es la resistencia de un sólido a rayarse. No se debe confundir con tenacidad, que es la resistencia a romperse. Así, por ejemplo, un material como el vidrio es difícil de rayar (duro) pero fácil de romper (frágil).

El estado líquido
Los líquidos se caracterizan por tomar la forma de los recipientes que los contienen. Otras propiedades características de los líquidos son:
- Viscosidad: Es la dificultad que presentan las partículas de un líquido a desplazarse unas sobre otras. Así por ejemplo, el aceite es más viscoso que el vinagre o el petróleo más que el agua.
- Capilaridad: Son el resultado de las fuerzas que actúan entre el recipiente y el líquido que contiene. Son mayores cuanto más delgado sea el tubo que contiene al líquido. En los vegetales existen elementos tubulares finísimos por los cuales los líquidos ascienden hasta considerable altura.

El estado gaseoso
En los gases, las moléculas tienen tal libertad de movimiento que pueden abandonar el recipiente que las contiene si no está cerrado.
Cuando se quieren estudiar las propiedades de un gas, es primordial tener en cuenta: el volumen que ocupan, la presión a la que están sometidos y su temperatura. Estas características son inseparables, de forma que no se puede hacer mención de una de ellas sin tener en cuenta las otras dos. Es decir, un gas que se encuentre a 100ºC en un recipiente de 2 litros ejerce distinta presión que si en el mismo volumen hubiera una temperatura de 5ºC, o que si, a la misma temperatura, el volumen se aumentara a 15 litros.
Capítulo 3. MEZCLAS
Si juntamos varias sustancias como arena, sal, aceite y agua, se forma lo que llamamos una mezcla. En ella, cada uno de sus componentes mantiene su propia identidad; así la arena sigue siendo arena y el agua, agua, aunque a veces resulte difícil la identificación visual de cada uno.
Cuando una sustancia no está mezclada con ninguna otra decimos que se encuentra en estado puro (sustancia pura); esto no es habitual en la naturaleza, En general lo que observamos son varias sustancias agrupadas formando mezclas.
Tipos de mezclas.
Existen dos grandes grupos de mezclas:
- Mezcla homogénea: es imposible distinguir a simple vista sus componentes; por ejemplo el aire o el agua salada.
- Mezcla heterogénea: se pueden distinguir sus componentes a simple vista; por ejemplo el turrón duro o la mezcla de agua con arena.

También podemos clasificar las mezclas por el estado de sus componentes.:
- Mezclas sólido-sólido: Son mezclas en las que los componentes están en estado sólido como las maderas usadas para hacer el aglomerado utilizado en la fabricación de muebles, las aleaciones de metales (cobre y estaño para formar bronce) o la mezcla de arena y arcilla que forma el suelo de la naturaleza. Una mezcla importante de este tipo la constituye los residuos sólidos urbanos de nuestra basura (RSU). La tendencia actual es la separación en origen de estos sólidos para favorecer el reciclaje (vidrio, papel, envases, pilas y orgánicos).

- Mezclas sólido–líquido: Tanto el agua con arena como el agua salada son mezclas de un sólido (la arena o la sal) con un líquido (el agua). La primera es una mezcla heterogénea y la segunda homogénea.

- Mezclas gas-líquido: Cuando destapamos una cerveza o una gaseosa aparecen unas burbujas que salen del líquido a la atmósfera. Se trata de un gas (CO2) que se encuentra mezclado con el líquido y que al cambiar la presión, abriendo la botella, es expulsado al exterior. Otras mezclas de este tipo la encontramos en el agua del mar y de los ríos que contienen cierta cantidad de oxígeno disuelto necesario para la respiración de los animales acuáticos.

- Mezclas líquido-líquido: Hay líquidos que no se pueden mezclar, como el agua y el aceite y otros que sí, como el agua con el alcohol. El petróleo es otro ejemplo de mezcla de diferentes líquidos, todos ellos útiles como combustibles: gasolina, gasoil, fueloil, queroseno,…

- Mezcla gas-gas: El aire es la mezcla de gases más representativa desde el punto de vista de los seres vivos formado por nitrógeno (78%), oxígeno (21%) y argón (0,9%) principalmente (el resto de los gases no llega al 0,1%). Si el aire está contaminado, pueden aparecer otros gases como el dióxido de azufre (SO2), el trióxido de azufre (SO3), el dióxido de carbono (CO2), el monóxido de carbono (CO) o el dióxido de nitrógeno (NO2)

- Mezcla sólido-gas: El humo de las calefacciones o de los motores produce finísimas partículas que se mantienen en la atmósfera aumentando la contaminación atmosférica que produce problemas respiratorios.

Técnicas de separación de mezclas
- Cristalización: Cuando dejamos evaporar un líquido, las sustancias que lleva disueltas quedan depositadas en el fondo formando cristales. Es el método usado para obtener la sal marina.

- Decantación: Si se mezclan aceite y agua, el aceite queda superpuesto al agua. Con un embudo de decantación podemos eliminar el agua por la parte inferior y recuperar el aceite en la parte superior. Este método también es utilizado para separar sólidos de líquidos como se hace en las plantas depuradoras de aguas residuales en el tratamiento para su purificación.

- Adsorción: El carbón activo usado en las plantillas de las zapatillas deportivas para retener el mal olor es un ejemplo de este tipo de separación. También se usan filtros de carbón activo en el tratamiento de potabilización del agua. La adsorción es el proceso mediante el cual una sustancia retiene a otra sobre su superficie.

- Destilación: Si calentamos el petróleo tal como se obtiene de su yacimiento (crudo) en primer lugar se evaporarán los materiales más volátiles y más tarde los que tengan un punto de ebullición mayor. De esta forma se obtienen por separado los componentes del petróleo. Así por ejemplo, las gasolinas abandonan la mezcla antes de llegar a los 200ºC, el gasoil a los 270ºC,… Cada fracción de la mezcla se recoge a una temperatura distinta; por eso, el proceso se llama destilación fraccionada.
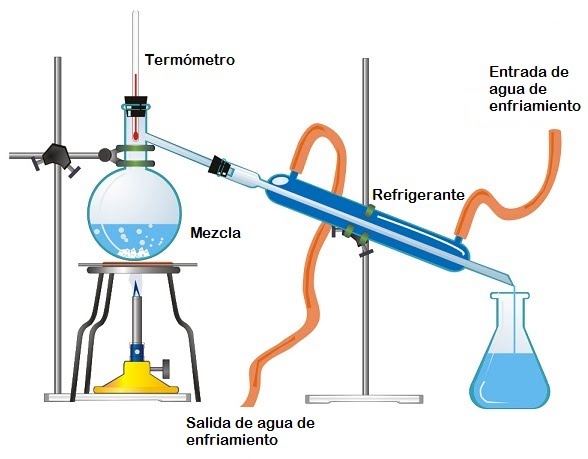
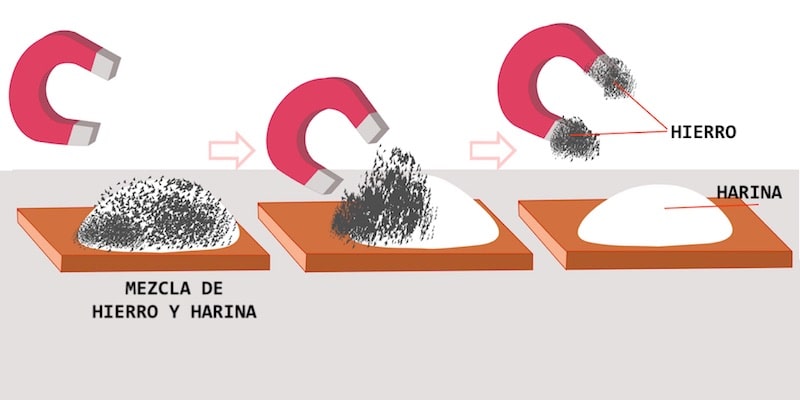
- Imanación: Sirve para separar metales ferrosos de otros materiales. En la industria son muy utilizados los electroimanes, imanes eléctricos de pequeño tamaño y gran potencia. Por ejemplo, se usan en la recuperación de metales de los RSU de los vertederos.
Capítulo 4. DISOLUCIONES
Una disolución es una mezcla homogénea en la que el componente que se encuentra en mayor cantidad se llama disolvente (suele ser agua) y al que se encuentra en menor proporción se le llama soluto. Así, en el agua salada, el agua es el disolvente y la sal el soluto.

Si preparamos una disolución añadiendo sal al agua y removemos con una cucharilla hasta que se disuelva, volviendo a añadir más sal y volviendo a agitar, llegará un momento en el que al echar más sal al agua ya no se disolverá y se quedará como sólido en el fondo del vaso. Se dice entonces que la disolución está saturada porque no admite más cantidad de soluto disuelto.

Se llama solubilidad a la cantidad máxima de soluto que se puede disolver en una determinada cantidad de disolvente. Es decir, que si podemos llegar a disolver 400 gramos de soluto en un litro de disolución diremos que la solubilidad es de 400 gramos por litro o bien 400 g/L. La solubilidad de los sólidos depende de la temperatura y en general, aumenta con ella. En el caso de los gases es al revés, al aumentar la temperatura la solubilidad disminuye. Aquí también influye la presión; si ésta aumenta, también aumenta la solubilidad.
Se llama concentración de una disolución a la relación que hay entre el soluto y el disolvente. Así, si en un litro de disolución hay 150 gramos de soluto, diremos que la concentración en ese instante es de 150 gr por litro, que se escribe 150 g/L. Esta proporción se mantiene sea cual sea el volumen de la disolución. Por ejemplo, si en un litro de disolución hay 150 gr de soluto, en medio litro habrá 75 gr y en 0,1 litro, 15 gramos siempre que la concentración sea de 150 g/L.
Por ello podemos decir que, si se quiere preparar medio litro de una disolución de concentración 100 g/L, la cantidad de soluto que deberemos preparar se calcula de la siguiente forma:
- si la concentración es de 100 gramos por litro, eso nos indica que en un litro de disolución hay 100 gramos de soluto
- como la relación debe mantenerse para cualquier volumen, se puede expresar de forma matemática como:
- es decir, deberemos tomar 50 gramos de soluto y rellenar hasta medio litro con agua.
Otro posible problema que tendríamos sería calcular la cantidad de soluto que tenemos en un volumen determinado de una disolución. Por ejemplo, para calcular que cantidad de soluto tendremos en ¼ de litro de la anterior disolución, operaríamos de la siguiente manera:
- Para resolverlo tenemos en cuenta la misma proporción que en el apartado anterior:
¿ Qué cantidad de disolución se necesitará tomar para tener 150 g de soluto?
Cuando la cantidad de soluto en la disolución es muy grande, ésta se encuentra próxima a la saturación. Se dice entonces que la disolución está concentrada. Sin embargo, si la concentración es muy pequeña, la cantidad de soluto también lo es y se dice que la disolución está diluida.
El agua ha sido siempre el disolvente por excelencia. Es el componente que se encuentra en mayor cantidad en los seres vivos por lo que la mayor parte de las transformaciones químicas biológicas se producen en disolución acuosa. También en el resto de la naturaleza es muy abundante y la mayoría de las sustancias naturales se disuelven en mayor o menor grado en agua, por lo que se ha definido al agua como el disolvente universal.
Capítulo 5. REACCIONES QUÍMICAS
Al proceso mediante el cual unas sustancias se transforman en otras se le denomina reacción química. Por ejemplo, cuando un metal se transforma en óxido por la acción del oxígeno del aire, se trata de una reacción química.
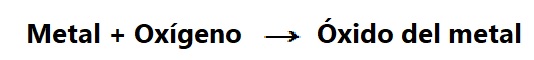
En cualquiera de las reacciones químicas debemos distinguir las sustancias que se transforman, llamadas reactivos, Y las nuevas que aparecen, que llamamos productos. Por ejemplo, en la transformación del metal en óxido, los reactivos son el metal y el oxígeno, mientras que el producto es el óxido del metal que se ha formado.
Pero también existen otras reacciones químicas que estamos acostumbrados a ver en nuestra vida diaria, por ejemplo, la combustión de la madera. En ella, la madera se transforma en un gas llamado dióxido de carbono, y vapor de agua.
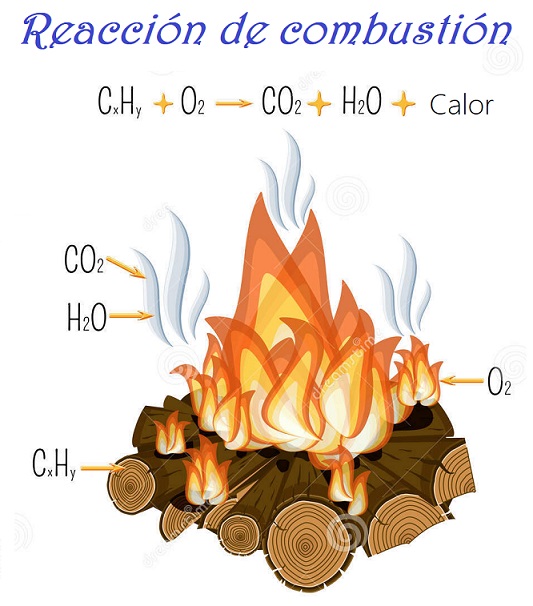
Además, este tipo de reacciones químicas (combustión) produce energía calorífica, por lo que el hombre las ha utilizado para protegerse del frío. Sin embargo, hay otras que precisa un aporte de energía para que puedan producirse, como la reacción de descomposición del agua en sus componentes, oxígeno e hidrógeno. A aquellas reacciones que producen energía durante el proceso se llama relaciones exotérmicas y aquellas que necesitan energía para que puedan realizarse son reacciones endotérmicas.
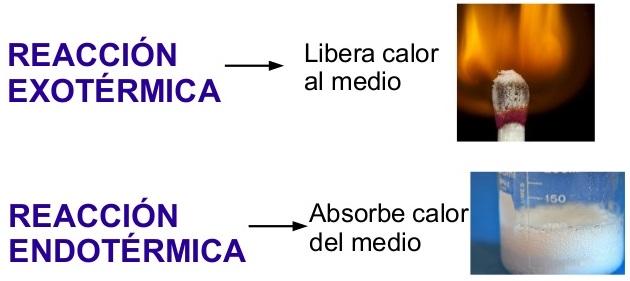
Por otra parte, existen reacciones químicas que se efectúan lentamente, como la oxidación de hierro que puede tardar varios días en apreciarse. Otras se realizan más rápidamente, como la combustión del papel, e incluso hay reacciones que se realizan a tal velocidad que pueden resultar explosivas.
Las ecuaciones químicas.
Las reacciones químicas se pueden representar mediante una ecuación. En ella podemos apreciar lo siguiente:
- Todas las sustancias que intervienen en la reacción vienen representadas por sus fórmulas.
- Una fecha separa las fórmulas de las sustancias que intervienen en la reacción; a la izquierda quedan los reactivos y a la derecha los productos.
- Delante de cada fórmula existe un número que nos indica cuántas moléculas de cada sustancia participan en la reacción.
- En la reacción se expresa la energía que interviene en el proceso; si hay que aportar energía (endotérmica), ésta aparece en el miembro de la izquierda y si la propia reacción desprende energía (exotérmica), se coloca a la derecha.
2 C4H10 + 13 O2 → 8 CO2 + 10 H2O + E (reacción 1)
De forma que la expresión que aparece en la ecuación anterior quiere decir: dos moléculas de gas butano relacionan con 13 moléculas de oxígeno para dar como productos de la reacción ocho moléculas de dióxido de carbono y 10 moléculas de agua. Además, mientras se efectúa la reacción se desprende energía.
Esta proporción se mantiene cuando cambia el número de moléculas que participan en la reacción, es decir, si una molécula de nitrógeno reacciona con tres de hidrógeno para dar dos de amoniaco se cumplirá que dos moléculas de nitrógeno reaccionarán con seis de hidrogeno para dar cuatro de amoniaco.
N2 + 3 H2 → 2 NH3 2 N2 + 6 H2 → 4 NH3 (reacción 2)
Si nos fijamos en los átomos que intervienen en la reacción 1 nos daremos cuenta de que el número de átomos de carbono que hay a la izquierda de la fecha son los correspondientes a las dos moléculas de butano (C4H10), es decir, dos moléculas, por cuatro que hay en cada molécula, 2 × 4 = 8 átomos de carbono. A la derecha de la fecha el número de átomos de carbono es el correspondiente al dióxido de carbono, un átomo en cada molécula por ocho moléculas es también igual a ocho.
Por otra parte, la proporción que se establece entre las moléculas que intervienen, se mantiene también si la trasladamos a los moles de cada sustancia que participan ella. Es decir, la afirmación para las moléculas de la reacción de la ecuación
2 C4H10 (g) + 13 O2 (g) → 8 CO2 (g) + 10 H2O (g)
puede establecerse con los correspondientes moles: dos moles de butano en estado gaseoso reaccionan con 13 moles de oxígeno en el mismo estado, para formar ocho moles de dióxido de carbono gas y 10 de agua también en estado gaseoso.
En la reacción N2 + 3 H2 → 2 NH3 , ¿cuántos moles de amoniaco se formarán a partir de siete de hidrógeno?. Para solucionarlo operaremos de la siguiente forma: buscamos las sustancias que intervienen (N2, H2 y NH3) y establecemos la proporción: tres moles de hidrógeno producen 2 de amoniaco por lo que:

Capítulo 6. LEY DE CONSERVACIÓN DE LA MASA. LEY DE LAVOISIER.
Recordando que 1 mol equivale a la masa molecular de una sustancia expresada en gramos, podemos calcular las masas de cualquier reactivo o producto que reacciona o se obtiene a partir de otra cantidad de otro reactivo o producto.
Es fácil comprobar que la masa total de todos los reactivos es igual a la masa total de los productos de la reacción. Es lo que se conoce como Ley de conservación de la masa o ley de Lavoisier.
Ejemplo. Dada la siguiente reacción:
2 ZnS + 3 O2 ⎯⎯→ 2 ZnO + 2 SO2.
¿Cuántos gramos ZnS reaccionarán con 40 gramos de O2 y cuántos gramos de ZnO y SO2 se formarán?
- La masa de 2 moles de ZnS será: m = n · M = 2 mol · 97,5 g/mol = 195 g.
- Igualmente, la masa de 3 moles de O2: m = 3 mol · 32 g/mol = 96 g
- 2 moles de ZnO equivalen a: : m = 2 mol · 81,4 g/mol = 162,8 g
- 2 moles de SO2 equivalen a: : m = 2 mol · 64,1 g/mol = 128,2 g

- Se obtienen tres proporciones que permiten calcular las masas de ZnS, ZnO y SO2:
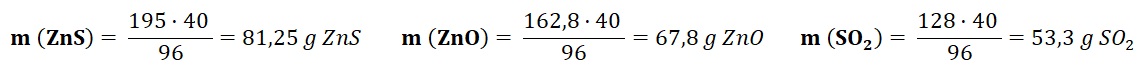
Capítulo 7. LA QUÍMICA EN LA SOCIEDAD Y EN EL MEDIO AMBIENTE.
Las reacciones químicas tanto industriales como naturales, así como reacciones de la actividad humana, como la combustión de la gasolina y el carbón de calefacción, influyen en el medio ambiente pudiendo contaminar éste de sustancias tóxicas o que produzcan efectos nocivos en él. La contaminación puede producirse tanto en el aire, como en las aguas como en el suelo.
Contaminación del aire.
- Incremento del efecto invernadero. Se produce por las emisiones de CO2 tanto industriales como de la combustión de los motores de los automóviles. Igualmente influye en este alto nivel de dióxido de carbono la deforestación que produce un menor consumo de este gas por las masas forestales. El CO2 produce una capa en la atmósfera que impide que la radiación solar que incide sobre la Tierra pueda escapar de ésta, con lo que se produce un aumento progresivo en la temperatura global del planeta con efectos negativos tales como el deshielo progresivo de los polos con el aumento del nivel del mar, así como el aumento en las sequías que provoca daños a veces irreparables en flora y fauna.

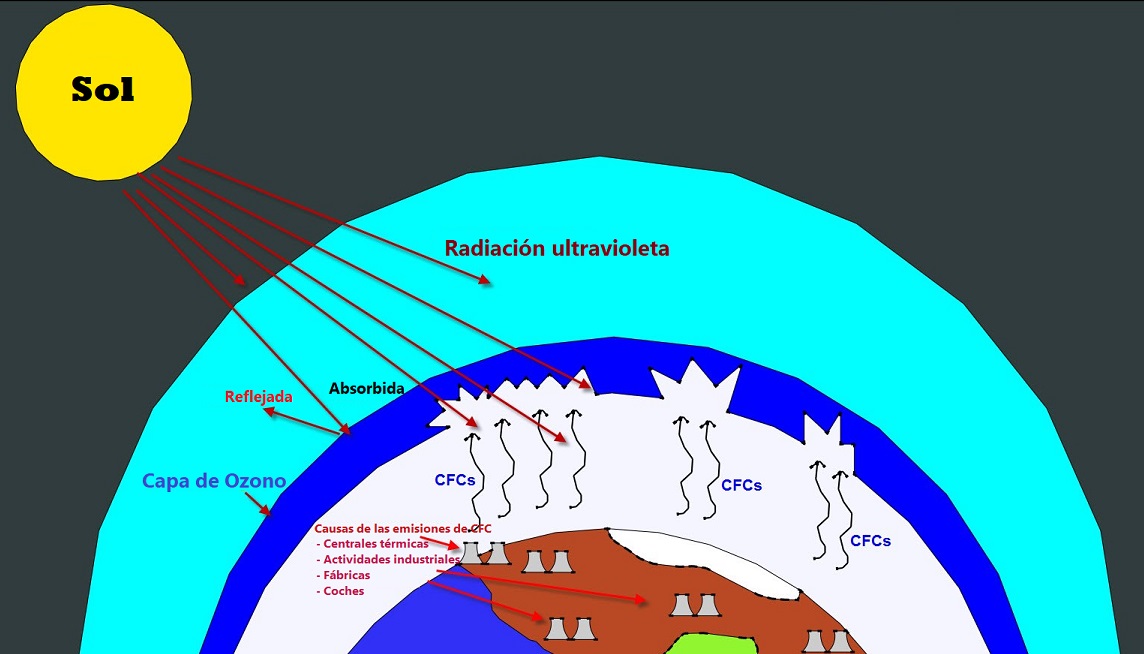
- Destrucción de la capa de ozono. Se produce por la emisión de gases que contienen cloro (CFC) que existían en algunos sprays y en los sistemas de refrigeración; estos gases, al llegar a la estratosfera, en donde se encuentra la capa de ozono, liberan átomos de cloro, siendo cada uno de ellos de romper muchas moléculas de ozono (O3) y transformarlo en oxígeno y monóxido de cloro (Cl + O3 → ClO + O2). La importancia del ozono se debe a que es un filtro muy importante que impide que se cuelen en la atmósfera una cantidad muy importante de rayos ultravioleta que son dañinos, por producir cáncer de piel, cataratas e incluso alteraciones genéticas (mutaciones).
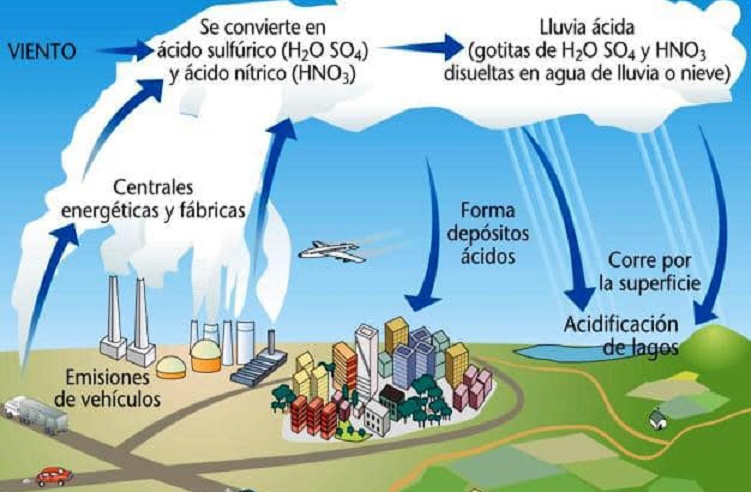
- Lluvia ácida. Se produce por la emisión a la atmósfera de óxidos de azufre y de nitrógeno, que al reaccionar con el agua de la atmósfera (nubes) forma ácidos sulfúrico y nítrico, que al caer con las precipitaciones producen efectos devastadores sobre los bosques, así como la acidificación del suelo e incluso la destrucción de monumentos histórico-artísticos fabricados con piedra caliza, muy vulnerable a la acción de los ácidos.
Contaminación de las aguas.
Se produce por roturas en las instalaciones que contienen residuos tóxicos, tales como metales pesados (plomo, mercurio…), como la producida en 1998 en Alnazcollar que contaminó gravemente el parque Nacional de Doñana. También puede producirse por vertidos incontrolados de algunas empresas y por el calentamiento artificial de las aguas cuando éstas se utilizan como sistemas de refrigeración, tal y como ocurre en las centrales nucleares, que al elevar la temperatura disminuye la concentración de oxígeno disuelto, necesario para la supervivencia de algunos peces. Igualmente, la contaminación puede producirse por microorganismos tales como bacterias u hongos, que producen enfermedades a los animales que ingieren dichas aguas.
Contaminación del suelo.
El suelo suele contaminarse fundamentalmente por la gran cantidad de residuos sólidos urbanos que la civilización trae consigo y también por residuos agrícolas (pesticidas) o industriales, como los aceites y productos químicos. Si el suelo se contamina llega a hacer imposible su explotación agrícola o ganadera. La contaminación del suelo suele estar asociada con la contaminación de las aguas
